En este artículo, vamos a resolver algunos ejercicios relacionados con los números cuánticos y la configuración electrónica. Estos conceptos son fundamentales para comprender la estructura de los átomos y cómo se organizan los electrones en ellos.
¿Qué son los números cuánticos?
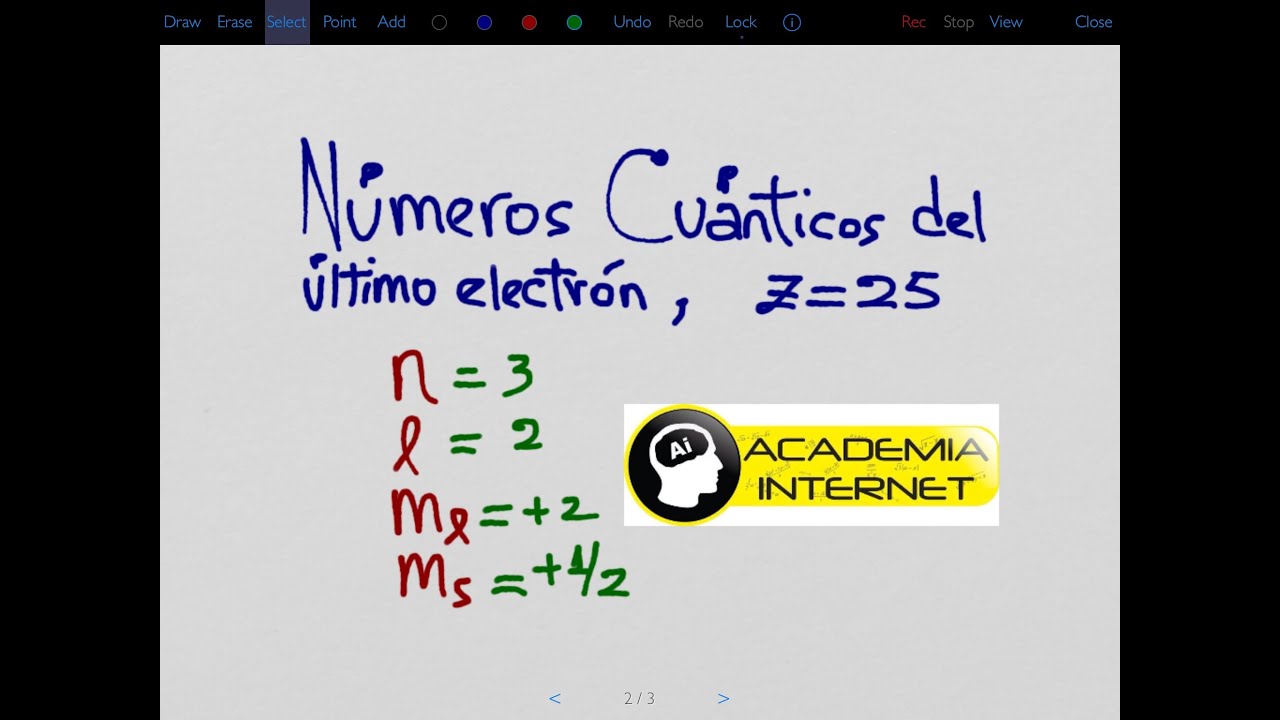
Los números cuánticos son los valores que describen las propiedades cuánticas de los electrones en un átomo. Son utilizados para determinar la posición, la energía y la orientación de los electrones en un sistema atómico.
Número cuántico principal (n)
El número cuántico principal, representado por la letra “n”, indica el nivel de energía en el que se encuentra un electrón. Los valores posibles de n son números enteros positivos, comenzando desde 1 hasta el número máximo de niveles de energía permitidos en un átomo.
Número cuántico azimutal (l)
El número cuántico azimutal, representado por la letra “l”, especifica la forma orbital en la que se encuentra un electrón. Los valores de l son números enteros no negativos que van desde 0 hasta n-1, donde n es el número cuántico principal. Cada valor de l corresponde a una forma orbital específica: l=0 para la forma orbital s, l=1 para la forma orbital p, l=2 para la forma orbital d, y l=3 para la forma orbital f.
Número cuántico magnético (m)
El número cuántico magnético, representado por la letra “m”, determina la orientación espacial de un electrón dentro de una forma orbital específica. Los valores de m van desde -l hasta l, incluyendo cero. Es decir, los valores posibles de m para un nivel de l son -l, -l+1, …, 0, …, l-1, l.
Número cuántico de espín (s)
El número cuántico de espín, representado por la letra “s”, indica la orientación del espín de un electrón. Los valores posibles de s son +1/2 y -1/2, que representan los dos posibles estados de espín de un electrón.
Configuración electrónica
La configuración electrónica de un átomo describe cómo se distribuyen los electrones en los diferentes niveles y subniveles de energía. Se representa mediante una secuencia de números cuánticos principales y azimutales, indicando el número de electrones presentes en cada nivel y subnivel.
Regla de la Aufbau
La regla de la Aufbau establece que los electrones se colocan en los niveles y subniveles de energía más bajos disponibles antes de ocupar los niveles y subniveles de energía más altos. Esto significa que los electrones se llenan secuencialmente, comenzando desde el nivel más bajo (n=1) y avanzando hacia arriba.
Regla de Hund
La regla de Hund establece que, cuando hay varios subniveles de igual energía disponibles, como los subniveles p, d y f, los electrones tienden a ocuparlos de manera que maximicen su espín paralelo. Esto significa que los electrones tienden a ocupar cada uno de los subniveles con un electrón antes de llenarlos con pares de electrones con espín opuesto.
Ejercicios resueltos
1. Ejercicio de números cuánticos
Consideremos un átomo con número cuántico principal n=3. ¿Cuáles son los posibles valores de l y m para este nivel de energía?
Para un átomo con n=3, los posibles valores de l van desde 0 hasta n-1, es decir, 0, 1 y 2. Por lo tanto, los posibles valores de l para este nivel de energía son 0, 1 y 2.
Para cada valor de l, los posibles valores de m van desde -l hasta l. Por lo tanto, los posibles valores de m para l=0 son 0; para l=1 son -1, 0 y 1; y para l=2 son -2, -1, 0, 1 y 2.
Por lo tanto, los posibles valores de l y m para un átomo con n=3 son:
– l = 0, m = 0
– l = 1, m = -1, 0, 1
– l = 2, m = -2, -1, 0, 1, 2
2. Ejercicio de configuración electrónica
Consideremos el elemento magnesio (Z=12). Determina su configuración electrónica.
El número atómico de magnesio es 12, lo que significa que tiene 12 electrones. Según la regla de la Aufbau, los electrones se llenan secuencialmente en orden de energía ascendente.
Comenzando con el nivel de energía más bajo, que es n=1, colocamos los primeros 2 electrones en el subnivel s. Por lo tanto, la configuración electrónica de magnesio comienza como 1s².
Luego, pasamos al nivel de energía n=2. Colocamos los siguientes 2 electrones en el subnivel s, que está lleno. Por lo tanto, la configuración electrónica continúa como 1s² 2s².
Finalmente, colocamos los últimos 6 electrones en el subnivel p del nivel de energía n=2. Por lo tanto, la configuración electrónica de magnesio es 1s² 2s² 2p⁶.
En resumen, la configuración electrónica de magnesio es: 1s² 2s² 2p⁶.
Preguntas frecuentes
1. ¿Pueden los electrones compartir los mismo valores de todos los números cuánticos?
No, según el principio de exclusión de Pauli, dos electrones en un átomo no pueden tener el mismo conjunto de valores para todos los números cuánticos. Esto significa que no pueden tener los mismos valores de n, l, m y s. Sin embargo, pueden tener el mismo conjunto de valores para los números cuánticos n y l, siempre que tengan diferentes valores de m y/o s.
2. ¿Cuáles son las formas orbitales s, p, d y f?
Las formas orbitales s, p, d y f son diferentes formas tridimensionales en las que los electrones pueden encontrarse alrededor de un núcleo atómico. La forma orbital s es esférica y symmetrical, mientras que las formas orbitales p tienen forma de p-lobo y tienen una orientación específica en el espacio. Las formas orbitales d y f son más complejas y tienen múltiples lóbulos y orientaciones.
3. ¿Por qué es importante la configuración electrónica?
La configuración electrónica es importante porque determina las propiedades químicas y físicas de un elemento. La forma en que se distribuyen los electrones en los diferentes niveles y subniveles de energía influye en la capacidad de reaccionar y formar enlaces químicos. Además, la configuración electrónica es utilizada para predecir la estabilidad de los elementos y su capacidad para perder o ganar electrones en reacciones químicas.
Espero que este artículo te haya ayudado a comprender mejor los números cuánticos y la configuración electrónica. Si tienes alguna pregunta, no dudes en dejarla en los comentarios.