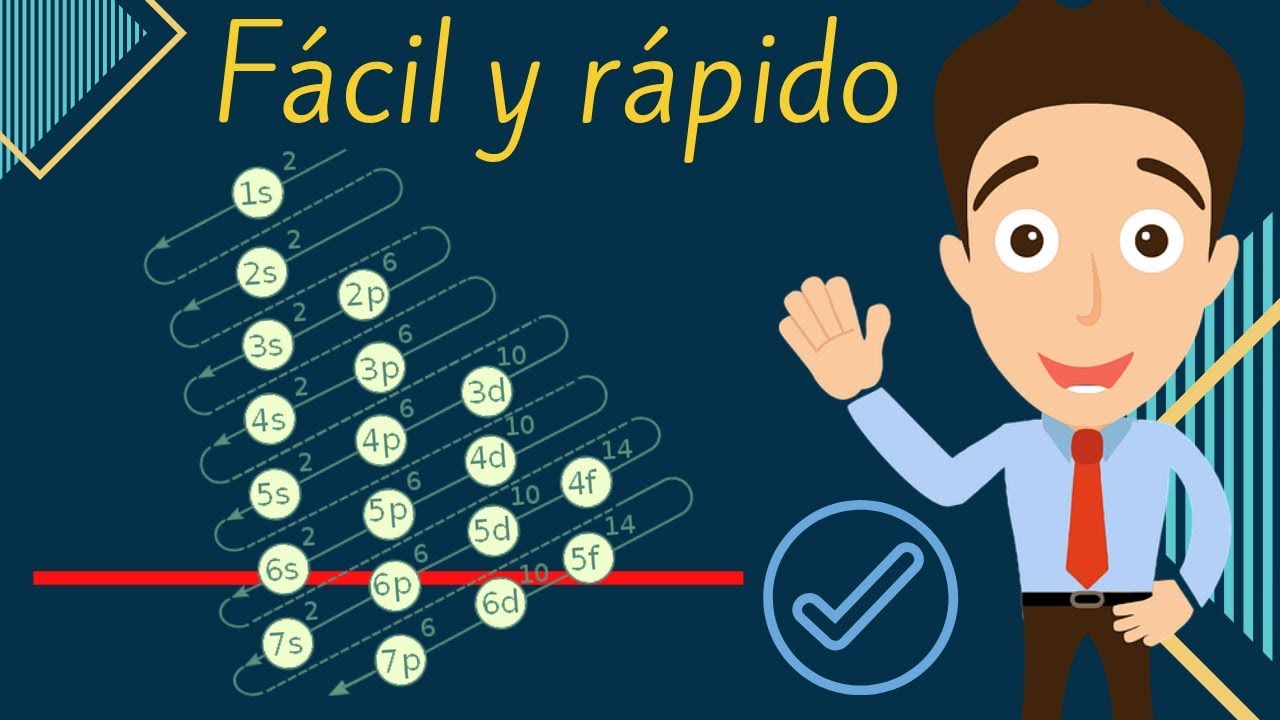
Ejercicios resueltos de configuración electrónica para 2º de bachillerato
¿Por qué es importante comprender la configuración electrónica?
Cuando se trata de la química y la física, comprender la configuración electrónica es crucial. La configuración electrónica de un átomo determina su comportamiento químico y sus propiedades físicas. Además, la configuración electrónica nos ayuda a entender cómo los electrones están distribuidos en los niveles de energía y en los subniveles de un átomo.
¿Cuál es la importancia de la notación de los átomos y los electrones?
La notación de los átomos y los electrones nos brinda información valiosa sobre su estructura y su comportamiento químico. Nos permite visualizar y comprender la organización de los electrones en los distintos niveles de energía y subniveles. Además, nos ayuda a predecir cómo estos electrones pueden interactuar con otros átomos y formar enlaces químicos.
Ejercicio 1: Configuración electrónica básica
Comencemos con un ejercicio básico para familiarizarnos con la configuración electrónica. Consideremos el átomo de oxígeno (O), que tiene 8 electrones. La notación de Lewis nos muestra que el símbolo del átomo se rodea de puntos que representan los electrones de valencia. En el caso del oxígeno, tenemos 6 electrones de valencia, por lo que la notación de Lewis sería O:.
La configuración electrónica del oxígeno se representa como 1s² 2s² 2p⁴. Esto indica que el oxígeno tiene 2 electrones en el nivel de energía 1s, 2 electrones en el nivel de energía 2s y 4 electrones en el nivel de energía 2p.
Ejercicio 2: Configuración electrónica de iones
En este ejercicio, vamos a analizar la configuración electrónica de iones. Consideremos el ión cloruro (Cl⁻), que tiene una carga negativa. Para determinar su configuración electrónica, primero debemos tener en cuenta que el cloro tiene 17 electrones en su estado neutro. Al perder un electrón para convertirse en un ión cloruro, su configuración electrónica se modifica.
La configuración electrónica del ión cloruro se representa como 1s² 2s² 2p⁶ 3s² 3p⁶. Esto indica que el ión cloruro tiene 2 electrones en el nivel de energía 1s, 2 electrones en el nivel de energía 2s, 6 electrones en el nivel de energía 2p, 2 electrones en el nivel de energía 3s y 6 electrones en el nivel de energía 3p.
Ejercicio 3: Configuración electrónica excepcional
En algunos casos, la configuración electrónica puede presentar excepciones. Consideremos el caso del cromo (Cr), que tiene 24 electrones. Siguiendo las reglas de llenado de orbitales, esperaríamos que la configuración electrónica del cromo sea 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁴. Sin embargo, la configuración real del cromo es 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ 3d⁵.
Esta configuración excepcional se debe a la estabilidad que se logra cuando el subnivel 3d está medio lleno (con 5 electrones) en lugar de completamente lleno (con 4 electrones) como se esperaría. Esta estabilidad compensa la energía adicional requerida para mover un electrón del subnivel 4s al subnivel 3d.
Ejercicio 4: Configuración electrónica de elementos periodicos
En este ejercicio, vamos a analizar la configuración electrónica de algunos elementos químicos en la tabla periódica. Comencemos con el hidrógeno (H), que tiene un solo electrón. Su configuración electrónica es simplemente 1s¹.
Ahora, veamos el caso del litio (Li), que tiene 3 electrones. Su configuración electrónica es 1s² 2s¹. Observa cómo los electrones se distribuyen en los niveles de energía disponibles.
Ejercicio 5: Configuración electrónica de elementos de transición
Los elementos de transición en la tabla periódica presentan configuraciones electrónicas particulares. Tomemos como ejemplo el cobre (Cu), que tiene 29 electrones. Siguiendo las reglas de llenado de orbitales, la configuración electrónica esperada para el cobre sería 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁹. Sin embargo, la configuración real del cobre es 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ 3d¹⁰.
Esta configuración excepcional se debe a la estabilidad que se logra cuando el subnivel 3d está completamente lleno (con 10 electrones) en lugar de casi lleno (con 9 electrones) como se esperaría. Nuevamente, la energía adicional requerida para mover un electrón del subnivel 4s al subnivel 3d se compensa con la estabilidad resultante.
Ejercicio 6: Configuración electrónica de elementos de transición interna
Los elementos de transición interna en la tabla periódica, como los lantánidos y actínidos, también presentan configuraciones electrónicas particulares. Tomemos como ejemplo el uranio (U), que tiene 92 electrones. Su configuración electrónica es 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p⁶ 5s² 4d¹⁰ 5p⁶ 6s² 4f¹⁴ 5d¹⁰ 6p⁶ 7s² 5f³ 6d¹.
En el caso del uranio, los electrones se distribuyen en varios niveles y en diferentes subniveles, lo que le confiere propiedades únicas. Estas configuraciones electrónicas particulares son importantes para entender el comportamiento y las propiedades de los elementos de transición interna.
Ejercicio 7: Configuración electrónica de iones y el efecto del número de electrones
El número de electrones de un átomo tiene un impacto significativo en su configuración electrónica y, por lo tanto, en su comportamiento químico. Consideremos el caso del magnesio (Mg), que tiene 12 electrones en su estado neutro. Su configuración electrónica es 1s² 2s² 2p⁶ 3s².
Si el magnesio pierde dos electrones para formar un ion magnesio positivo (Mg²⁺), su configuración electrónica se modifica a 1s² 2s² 2p⁶. Mientras que si el magnesio gana dos electrones para formar un ion magnesio negativo (Mg⁻²), su configuración electrónica se modifica a 1s² 2s² 2p⁶ 3s² 3p⁶.
Ejercicio 8: Configuración electrónica y la periodicidad de los elementos
La configuración electrónica de los elementos químicos está estrechamente relacionada con la periodicidad que se observa en la tabla periódica. La distribución de los electrones en los diferentes niveles y subniveles determina las propiedades y el comportamiento de los elementos.
Por ejemplo, todos los elementos del mismo grupo en la tabla periódica tienen configuraciones electrónicas similares en sus niveles de valencia. Esto contribuye a que estos elementos compartan propiedades químicas similares y a la existencia de patrones en la reactividad de los grupos de elementos.
Ejercicio 9: Configuración electrónica y estabilidad de los elementos
La configuración electrónica también tiene un impacto en la estabilidad de los elementos químicos. Algunas configuraciones electrónicas, como las de los gases nobles (grupo 18 de la tabla periódica), son particularmente estables debido a que sus niveles de valencia están completamente llenos.
Esta estabilidad se traduce en una baja reactividad de los gases nobles, ya que tienen una tendencia mínima a ganar, perder o compartir electrones para alcanzar la configuración de un gas noble. Por otro lado, los elementos que tienen configuraciones electrónicas inestables suelen ser más reactivos en comparación.
Ejercicio 10: Configuración electrónica y propiedades magnéticas
La configuración electrónica también tiene un impacto en las propiedades magnéticas de los elementos. Algunos elementos tienen electrones desapareados en sus subniveles, lo que les confiere un momento magnético y los convierte en paramagnéticos.
Por ejemplo, el oro (Au) tiene una configuración electrónica de 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p⁶ 5s² 4d¹⁰ 5p⁶ 6s² 4f¹⁴ 5d¹⁰. Con una configuración así, todos los electrones están apareados y el oro no presenta propiedades magnéticas significativas.
Ejercicio 11: Configuración electrónica y reactividad química
La configuración electrónica también tiene un impacto en la reactividad química de los elementos. Los elementos con una configuración electrónica estable suelen tener una baja reactividad, ya que no necesitan ganar, perder o compartir electrones para alcanzar la estabilidad.
En contraste, los elementos con una configuración electrónica inestable tienden a ser más reactivos, ya que intentan alcanzar la estabilidad a través de la transferencia o la compartición de electrones con otros átomos.
Ejercicio 12: Configuración electrónica y propiedades periódicas
Las propiedades periódicas de los elementos químicos, como el tamaño atómico, la energía de ionización y la electronegatividad, están influenciadas por la configuración electrónica. Estas propiedades varían de manera predecible en la tabla periódica y nos brindan información sobre la tendencia de los elementos a ganar, perder o compartir electrones.
Por ejemplo, el tamaño atómico tiende a aumentar hacia abajo en un grupo de la tabla periódica, ya que se agregan más niveles de energía y los electrones se encuentran más alejados del núcleo. Por otro lado, el tamaño atómico tiende a disminuir de izquierda a derecha en un periodo, ya que los electrones se agregan al mismo nivel de energía, pero el número de protones en el núcleo aumenta, lo que aumenta la fuerza de atracción y comprime el tamaño del átomo.
Ejercicio 13: Configuración electrónica y transiciones electrónicas
Las transiciones electrónicas, como las que ocurren en los espectros atómicos y moleculares, también están relacionadas con la configuración electrónica de los componentes involucrados. Estas transiciones se producen cuando un electrón absorbe o libera energía y salta de un nivel de energía a otro.
Un ejemplo famoso de una transición electrónica es la que ocurre en los átomos de hidrógeno cuando un electrón salta del nivel de energía 2 al nivel de energía 1, emitiendo un fotón de luz visible en el proceso. La energía del fotón emitido depende de la diferencia de energía entre los niveles involucrados y puede ser calculada a través de ecuaciones basadas en la configuración electrónica del átomo de hidrógeno.
Ejercicio 14: Configuración electrónica y la explicación de las propiedades físicas
La configuración electrónica también nos ayuda a explicar las propiedades físicas de los elementos químicos. Por ejemplo, la conductividad eléctrica y térmica de un metal se debe a la capacidad de los electrones para moverse libremente en una estructura metálica y transmitir carga y energía.
Por otro lado, los aislantes tienen una configuración electrónica que limita la movilidad de los electrones y, por lo tanto, restringe la transferencia de carga y energía. La configuración electrónica de los materiales también influye en su punto de fusión, densidad y otras propiedades físicas observables.
Ejercicio 15: Configuración electrónica y aplicaciones en la vida cotidiana
La configuración electrónica tiene numerosas aplicaciones en la vida cotidiana. Por ejemplo, la electrónica y la tecnología de semiconductores se basan en la configuración electrónica de materiales como el silicio y el germanio, que se utilizan en la fabricación de chips y dispositivos electrónicos.
Además, la comprensión de la configuración electrónica es fundamental en la investigación y desarrollo de nuevos materiales con propiedades específicas, como los superconductores, que pueden transportar corriente eléctrica sin resistencia y tienen aplicaciones en la medicina, la energía y otras industrias.
En resumen, la configuración electrónica es una herramienta poderosa para comprender el comportamiento y las propiedades de los elementos químicos. A través de ejercicios resueltos, hemos explorado cómo la configuración electrónica se relaciona con la estructura atómica, las propiedades periódicas, la reactividad química, las propiedades magnéticas y físicas, las transiciones electrónicas y las aplicaciones en la vida cotidiana. Continuar explorando y practicando ejercicios de configuración electrónica nos permitirá profundizar nuestra comprensión y dominio en este tema fundamental de la química.
Preguntas frecuentes
1. ¿Por qué es importante aprender configuración electrónica?
La configuración electrónica nos ayuda a comprender cómo los electrones están distribuidos en los átomos y cómo esto afecta sus propiedades químicas y físicas. Es importante para entender la estructura atómica, la formación de enlaces químicos, la reactividad de los elementos y muchas otras áreas de la química y la física.
2. ¿Cómo se representa la configuración electrónica?
La configuración electrónica se representa utilizando la notación de números cuánticos y letras para los niveles de energía y subniveles. Por ejemplo, la configuración electrónica del oxígeno es 1s² 2s² 2p⁴, donde 1s, 2s y 2p son los niveles y subniveles de energía, y los superíndices representan el número de electrones en cada