La configuración electrónica es una parte fundamental del estudio de la química y la física. En este artículo, te presentaremos una serie de ejercicios resueltos de configuración electrónica diseñados especialmente para estudiantes de 3º de ESO.
¿Qué es la configuración electrónica?
La configuración electrónica es la distribución de los electrones de un átomo en sus diferentes niveles y subniveles de energía. Cada electrón ocupa una posición única en el átomo, y entender cómo se distribuyen es crucial para entender cómo los átomos interactúan entre sí en las reacciones químicas.
¿Por qué es importante entender la configuración electrónica?
Comprender la configuración electrónica de los átomos nos permite predecir su comportamiento químico y entender cómo se forman los enlaces químicos. También nos ayuda a explicar las propiedades físicas y químicas de los elementos y a predecir su reactividad con otros elementos.
¿Cómo se representa la configuración electrónica?
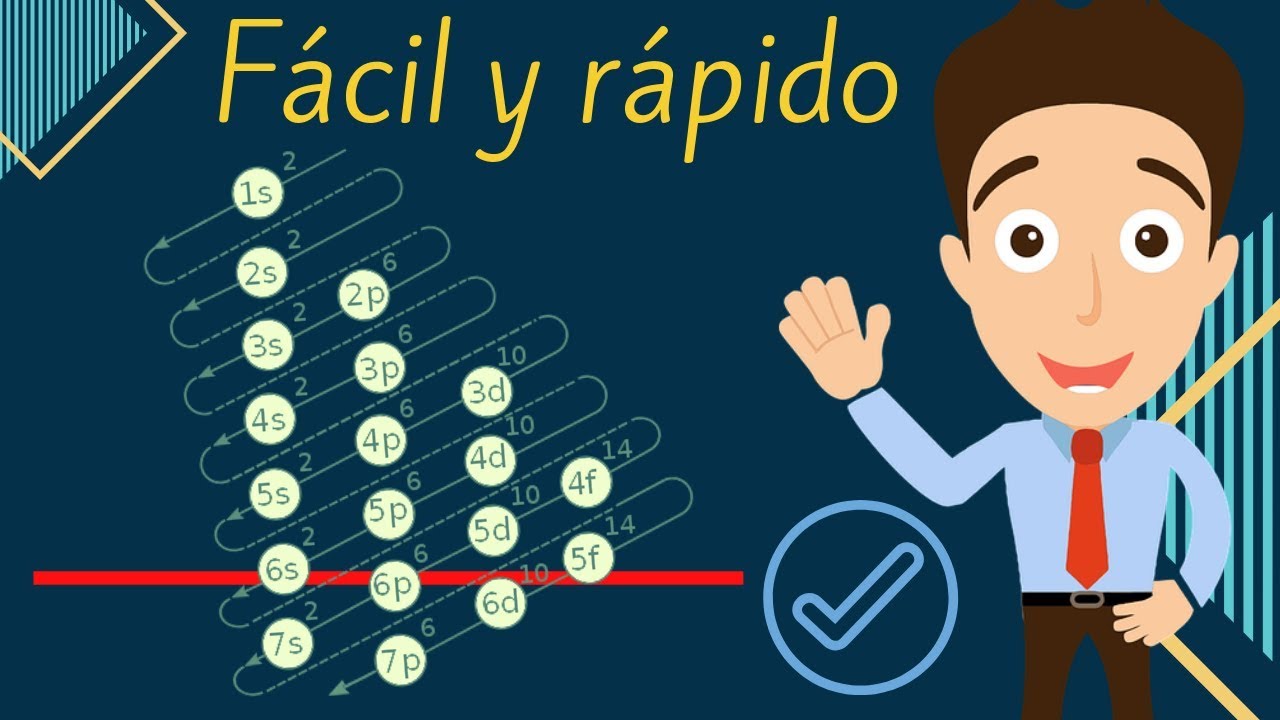
La configuración electrónica se representa utilizando números y letras que indican los niveles y subniveles de energía ocupados por los electrones en un átomo. Cada subnivel se representa con una letra (s, p, d, f) y se le asignan números que indican el número de electrones presentes en ese subnivel.
¿Cuál es la regla de Aufbau?
La regla de Aufbau es una regla que establece que los electrones se llenan en los subniveles de energía más bajos primero, antes de ocupar los subniveles de energía superiores. Esto significa que los electrones se llenan en orden ascendente de energía: primero el subnivel 1s, luego el 2s, después los subniveles 2p, y así sucesivamente.
¿Qué significa el número y la letra en la configuración electrónica?
El número en la configuración electrónica indica la cantidad de electrones presentes en ese subnivel, mientras que la letra representa el tipo de subnivel (s, p, d, f). Por ejemplo, en la configuración electrónica del oxígeno (O) – 1s2 2s2 2p4 – el número 2 indica que hay 2 electrones en el subnivel 2s, mientras que la letra «p» indica que hay electrones en el subnivel 2p.
Ejercicios resueltos de configuración electrónica
Ejercicio 1:
Calcula la configuración electrónica del magnesio (Mg).
Solución:
El magnesio tiene 12 electrones. Siguiendo la regla de Aufbau, llenamos los subniveles de energía en orden ascendente. Comenzamos con el subnivel 1s, que puede contener un máximo de 2 electrones. Luego, llenamos el subnivel 2s, que también puede contener un máximo de 2 electrones. Finalmente, llenamos el subnivel 2p, que puede contener un máximo de 6 electrones. La configuración electrónica del magnesio es 1s2 2s2 2p6.
Ejercicio 2:
Calcula la configuración electrónica del cloro (Cl).
Solución:
El cloro tiene 17 electrones. Siguiendo la regla de Aufbau, llenamos los subniveles de energía en orden ascendente. Comenzamos con el subnivel 1s, que puede contener un máximo de 2 electrones. Luego, llenamos el subnivel 2s, que también puede contener un máximo de 2 electrones. Finalmente, llenamos el subnivel 2p, que puede contener un máximo de 6 electrones. La configuración electrónica del cloro es 1s2 2s2 2p6 3s2 3p5.
La configuración electrónica es una herramienta poderosa que nos permite entender el comportamiento químico de los átomos y predecir sus propiedades. Con los ejercicios resueltos presentados en este artículo, esperamos haber aclarado tus dudas y ayudarte a fortalecer tus conocimientos en este tema.
¿Tienes alguna otra pregunta sobre la configuración electrónica?
No dudes en dejar tus preguntas en los comentarios y estaremos encantados de responderte.